Modelo Brusselator de Reação-Difusão: mudanças entre as edições
Sem resumo de edição |
|||
| Linha 5: | Linha 5: | ||
==Modelo de Brusselator== | ==Modelo de Brusselator== | ||
O estudo de sistemas químicos e biológicos frequentemente requer o uso de modelos que caracterizam reações de reação-difusão. Um dos modelos mais utilizados é o modelo de Brusselator, que é utilizado para descrever o mecanismo químico de reação-difusão com oscilações não lineares. <ref>J. Tyson, Some further studies of nonlinear oscillations in chemical systems, J. Chem. Phys. 58 (1973) 3919</ref>. Turing | O estudo de sistemas químicos e biológicos frequentemente requer o uso de modelos que caracterizam reações de reação-difusão. Um dos modelos mais utilizados é o modelo de Brusselator, que é utilizado para descrever o mecanismo químico de reação-difusão com oscilações não lineares. <ref>J. Tyson, Some further studies of nonlinear oscillations in chemical systems, J. Chem. Phys. 58 (1973) 3919</ref>. Turing observou que quando determinadas reações são associadas a difusão, é possível obter um padrão espacial estável, e isso leva a teoria de morfogênese<ref>Turing A. M., The chemical basis of morphogenesis. 1953. Bull. Math. Biol. 52, 153, discussion 119 (1990).</ref>. Além de processos de reação-difusão, o modelo Brusselator é observado em reações enzimáticas e na física de plasma e de lasers. | ||
O mecanismo de Brusselator<ref>I. Prigogine, R. Lefever, Symmetries breaking instabilities in dissipative systems II. J. Phys. Chem. 48, 1695–1700 (1968)</ref> proposto por Prigogine (1970) é dado por: | O mecanismo de Brusselator<ref>I. Prigogine, R. Lefever, Symmetries breaking instabilities in dissipative systems II. J. Phys. Chem. 48, 1695–1700 (1968)</ref> proposto por Prigogine (1970) é dado por: | ||
| Linha 14: | Linha 14: | ||
:<math>U \to E</math> (1.d) | :<math>U \to E</math> (1.d) | ||
Onde U e V são as espécies químicas de interesse. Assumimos A e B em excesso para que o sistema não atinja o equilíbrio. Esse sistema químico foi importante para o avanço na área de sistemas complexos porque possibilita o uso de modelos matemáticos de duas dimensões, já que U e V são variáveis dependentes, e admite | Onde U e V são as espécies químicas de interesse. Assumimos A e B em excesso para que o sistema não atinja o equilíbrio. Esse sistema químico foi importante para o avanço na área de sistemas complexos porque possibilita o uso de modelos matemáticos de duas dimensões, já que U e V são variáveis dependentes, e admite oscilações de ciclo limite<ref>R. Lefever and G. Nicolis, Chemical instabilities and sustained oscillations, J. Theor. Biol. 30 (1971)</ref>. | ||
As equações diferenciais parciais associadas com o sistema Brusselator | As equações diferenciais parciais associadas com o sistema Brusselator<ref>G. Adomian, The diffusion-Brusselator equation. Comput. Math. Appl. 29, 1–3 (1995)</ref> são dadas por: | ||
:<math>\frac{\partial u}{\partial t} = a + u^2v - (b+1)u + D_u \left(\frac{\partial ^2 u}{\partial x^2} + \frac{\partial ^2 u}{\partial y^2} \right)</math> | :<math>\frac{\partial u}{\partial t} = a + u^2v - (b+1)u + D_u \left(\frac{\partial ^2 u}{\partial x^2} + \frac{\partial ^2 u}{\partial y^2} \right)</math> | ||
Edição das 22h38min de 13 de março de 2022
Grupo: Carolina Lenzi, Eric Naiber e Vitória Xavier
O objetivo deste trabalho é implementar o modelo de reação-difusão Brusselator em duas dimensões, frequentemente utilizado para estudar sistemas complexos químicos e biológicos. O modelo é um sistema não linear de equações diferenciais parciais e foi proposto em 1970 por Ilya Prigogine e seus colaboradores da Universidade Livre de Bruxelas. Desde então tem sido aplicado para analisar reações oscilatórias e autocatalíticas. O método computacional utilizado para implementar o modelo foi o método FTCS (Forward Time Centered Space).
Modelo de Brusselator
O estudo de sistemas químicos e biológicos frequentemente requer o uso de modelos que caracterizam reações de reação-difusão. Um dos modelos mais utilizados é o modelo de Brusselator, que é utilizado para descrever o mecanismo químico de reação-difusão com oscilações não lineares. [1]. Turing observou que quando determinadas reações são associadas a difusão, é possível obter um padrão espacial estável, e isso leva a teoria de morfogênese[2]. Além de processos de reação-difusão, o modelo Brusselator é observado em reações enzimáticas e na física de plasma e de lasers.
O mecanismo de Brusselator[3] proposto por Prigogine (1970) é dado por:
- (1.a)
- (1. b)
- (1.c)
- (1.d)
Onde U e V são as espécies químicas de interesse. Assumimos A e B em excesso para que o sistema não atinja o equilíbrio. Esse sistema químico foi importante para o avanço na área de sistemas complexos porque possibilita o uso de modelos matemáticos de duas dimensões, já que U e V são variáveis dependentes, e admite oscilações de ciclo limite[4].
As equações diferenciais parciais associadas com o sistema Brusselator[5] são dadas por:
onde e são as concentrações a serem investigadas em função de tempo e espaço, e são constantes relativas às concentrações dos reagentes A e B, e e constantes de difusão.
A solução analítica do sistema reação-difusão Brusselator ainda não é conhecida e por isso há o interesse de explorá-la numericamente.
Análise da estabilidade do sistema
Análise de ponto crítico
Considerando o sistema livre de difusão, quando :
Onde e e e são constantes positivas e reais. A matriz jacobiana no ponto crítico é dada por
Os autovalores de são os valores que satisfazem a equação caracterísitca
Os autovalores claramente mostram dependência em e no determinante . Esses autovalores governam a estabilidade do ponto crítico ou determinam a existência de um ciclo limite. As propriedades de estabilidade ou a existência de um ciclo limite estão sumarizadas na tabela abaixo, em relação a figura 1.
[[Arquivo:]]
Utilizando a teoria Hopf, é mostrado que o ponto crítico perde sua estabilidade quando A e B movem da região 2 para região 3, na figura 1, atravessando a curva . Uma bifurcação Hopf ocorre quando ao passo que essa curva é atravessada e um ciclo limite estável existe para A e B nas regiões 1 e 2, mas não para A e B nas regiões 3 e 4.
Conclui-se que a curva governa a estabilidade do sistema.
Análise de ponto fixo
O estado estacionário do sistema pode ser encontrado igualando o coeficiente de difusão, e portanto as derivadas parciais, a zero. Percebe-se que esse sistema converge para os pontos fixos:
Em [twizell] a manipulação da matriz jacobiana nos pontos fixos resulta nos seguintes autovalores
Onde fica claro que os denominadores dos autovalores são sempre positivos quando and . As inequações
- e
São verdadeiras sempre que . Portanto, uma condição suficiente para o ponto fixo atrair a sequência gerada pelo sistema é .
Ainda em [Twizell] o modelo reação-difusão Brusselator foi discretizado e a análise dos pontos fixos concluiu que o sistema converge para e , sendo esse o único estado estacionário do sistema.
Concluiu que também que o sistema apresenta estado oscilatório quando
Estado em que o sistema não converge para nenhum ponto.
Método FTCS
O FTCS (Forward Time Centered Space) é um método de diferença finita que utiliza a derivada à direita ("para frente") no tempo e a derivada segunda centralizada no espaço para discretizar as variáveis. As derivadas no tempo e no espaço bidimensional ficam:
Substituindo nas equações do Brusselator
onde e são as funções que representam a reação sem difusão.
Utilizamos discretização do tipo
Utilizando a notação , assumindo e rearranjando os termos, reescrevemos as equações como
onde e .
Análise de estabilidade
A análise de estabilidade do método FTCS pode ser feita com a análise local de von Neumann. Para isso precisamos linearizar as equações do modelo Brusselator e escrever as soluções em modos de Fourier, da seguinte forma:
Para que o método seja estável, é preciso que . Após inserir as soluções nas equações linearizadas e realizar manipulações algébricas, como feito por Scholz (2009)[6], obtemos
onde
e
Os valores e satisfazem a condição de estabilidade, como mostrado em [6].
Implementação
O método foi implementado em Python, utilizando as constantes definidas na tabela abaixo.
Os valores de e as condições iniciais foram variados, como descrito na seção de resultados.
A seguir, o trecho do código relativo à implementação do método. O código completo encontra-se no Github [1]
# u_n, v_n -> concentracao dos reagentes no tempo n (matriz Nx x Ny)
# u_n1, v_n1 -> concentracao dos reagentes no tempo n+1
# Nx, Ny -> Tamanho do recipiente
while t < t_max:
for i in range(Nx):
i_e = (i - 1) % Nx # garante que o vizinho a esquerda de 0 é o da ultima posicao
i_d = (i + 1) % Nx # garante que vizinho a direita da ultima posicao é o zero
for j in range(Ny):
j_e = (j - 1) % Ny
j_d = (j + 1) % Ny
u_n1[i, j] = u_n[i, j] + dt * f(u_n[i, j], v_n[i, j], b) \
+ ku * (u_n[i_e, j] + u_n[i_d, j] + u_n[i, j_e] + u_n[i, j_d] - 4 * u_n[i, j])
v_n1[i, j] = v_n[i, j] + dt * g(u_n[i, j], v_n[i, j], b) \
+ kv * (v_n[i_e, j] + v_n[i_d, j] + v_n[i, j_e] + v_n[i, j_d] - 4 * v_n[i, j])
# atualizar u_n e v_n
for i in range(Nx):
for j in range(Ny):
u_n[i, j] = u_n1[i, j]
v_n[i, j] = v_n1[i, j]
t += dt
Resultados
Esta seção se dedica ao resultados das simulações realizadas, que mostram o caráter oscilatório do Brusselator ao longo do tempo e também como se dá a difusão dos reagentes em um recipiente em duas dimensões. As constantes utilizadas foram identificadas abaixo para plotar os gráficos (exceto quando indicado o contrário).
| Tabela de Constantes e Valores | |||||
|---|---|---|---|---|---|
| Símbolo | Nome | Valor | |||
| Dimensão analisada ao longo do eixo x | 50 | ||||
| Dimensão analisada ao longo do eixo y | 50 | ||||
| Constante relativa à concentração do reagente A | 1 | ||||
| Constante relativa à concentração do reagente B | - | ||||
| Constante de difusão do reagente U | 0.5 | ||||
| Constante de difusão do reagente V | 1 | ||||
| Concentração de u no tempo inicial (t=0) | - | ||||
| Concentração de v no tempo inicial (t=0) | - | ||||
| Passo de tempo entre iterações | 0.01 | ||||
| Unidade de avanço dos eixos no espaço | 1 | ||||
As posições das condições iniciais foram escolhidas arbitrariamente, tendo um total de 6 modos que serão explicados logo à frente, sendo eles:
- Condição em formato do sinal "+".
- Condição de borda.
- Condição aleatória.
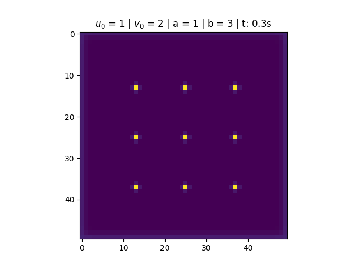
- Condição de nove pontos centrais.
- Condição da borda completa.
Simulação
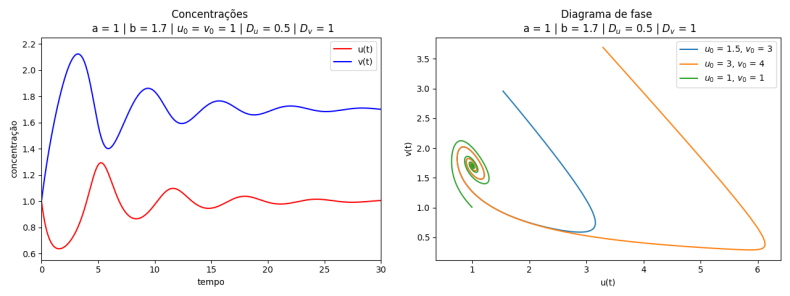
Nas figuras abaixo temos a variação das concentrações dos reagentes ao longo do tempo e os diagramas de fase. Para e notamos que a solução do sistema converge para e . Esse resultado está de acordo com o esperado, pois o ponto é um ponto fixo atrator (satisfaz que ), conforme demonstrado na seção de análise de estabilidade do Brusselator. Notamos também, pelo diagrama de fase, que mesmo alterando as condições iniciais do problema, a solução converge para o estado estacionário.
Para e , temos que , portanto a solução do sistema não converge. O que observamos é um comportamento periódico.
Note que quando diminui, aumenta rapidamente, mantendo-se um ciclo oscilatório em que a amplitude das ondas de e vão diminuindo ao longo do tempo (ou não, dependendo das constantes e teremos outros comportamentos), como mostrado nas figuras.
Pensando no gráfico da reação-difusão como ondas, é correto afirmar que ambas juntas formam um padrão de interferência destrutiva. A animação abaixo mostra exatamente este comportamento, observe o reagente no gráfico da direita. Note que quando o ponto do gráfico da esquerda chega ao mínimo local, o valor de é alto e o de muito baixo, fazendo com que o gráfico da direita fique muito amarelo (amarelo significa uma alta concentração de sendo formada).
É interessante pensar no gráfico da esquerda como a análise em um ponto específico dentro do recipiente, por exemplo, se estamos analisando o ponto . Tendo isso em mente conseguimos analisar os outros 3 cantos da figura, já que por simetria da posição inicial escolhida, os cantos são iguais.
Condições Iniciais
Para observar melhor os resultados, foram feitas diversas condições iniciais que foram separadas em tópicos citados em Definindo Constantes.
Levando em consideração que u_n é um array de tamanho por .
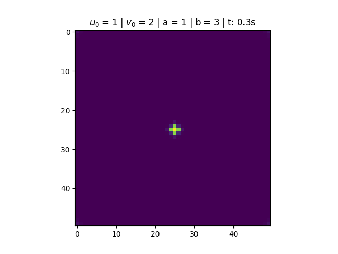
Condição em Formato do Sinal "+"
O reagente é distribuído no centro formando um sinal de "+".
# u_n [Nx, Ny]
# Centro
u_n[int(Nx / 2), int(Ny / 2)] = u0
# Lateral do sinal
# X Y
u_n[int(Nx / 2) + 1, int(Ny / 2)] = u0
u_n[int(Nx / 2) - 1, int(Ny / 2)] = u0
# Altura do sinal
# X Y
u_n[int(Nx / 2), int(Ny / 2) + 1] = u0
u_n[int(Nx / 2), int(Ny / 2) - 1] = u0
Condição de borda
O reagente foi distribuído nos 4 cantos do recipiente.
# u_n [Nx, Ny]
# Sup Esq
v_n[0, 0] = v0
# Sup Dir
v_n[0, Nx - 1] = v0
# Inf Esq
v_n[Nx - 1, 0] = v0
# Inf Dir
v_n[Nx - 1, Nx - 1] = v0
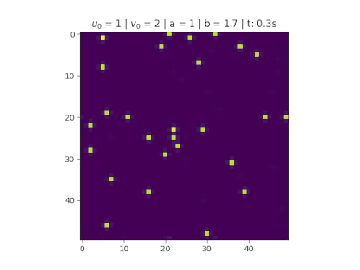
Condição aleatória
Os reagentes são aleatoriamente distribuídos ao longo do recipiente, a quantidade de focos de reagente também é aleatória para e .
from random import *
# u_n [Nx, Ny]
aleatorio = randint(int(Nx / 5)
# Aleatório para u
for _ in range(aleatorio, Nx)):
u_n[randint(0, size), randint(0, size)] = u0
# Aleatório para v
for _ in range(aleatorio, Nx)):
v_n[randint(0, size), randint(0, size)] = v0
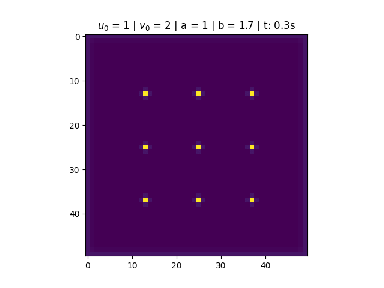
Condição de nove pontos centrais
Foi utilizado na figura 3.
No centro divide 9 pontos igualmente espaçados de tamanho , para .
# Nove pontos centrais (u0)
mid = int(Nx / 2); mov = int(Nx / 4)
# Meio & direita
u_n[mid, mid] = u0
u_n[mid + mov, mid + mov] = u0
# Meio & esquerda
u_n[mid + mov, mid] = u0
u_n[mid, mid + mov] = u0
# Meio, p/baixo & p/lados
u_n[mid + mov, mid - mov] = u0
u_n[mid - mov, mid - mov] = u0
# Meio, p/cima & p/lados
u_n[mid - mov, mid] = u0
u_n[mid, mid - mov] = u0
u_n[mid - mov, mid + mov] = u0
Condição da borda completa
Foi utilizado na figura 3.
Completa toda a borda do recipiente com reagente .
# v_n = [Nx, Ny]
# Toda a borda (v0)
for i in range(Nx):
# Completa primeira coluna e primeira linha
v_n[0, i] = v0
v_n[i, 0] = v0
# Completa última coluna e última linha
v_n[Nx - 1, i] = v0
v_n[i, Nx - 1] = v0
Referências
- ↑ J. Tyson, Some further studies of nonlinear oscillations in chemical systems, J. Chem. Phys. 58 (1973) 3919
- ↑ Turing A. M., The chemical basis of morphogenesis. 1953. Bull. Math. Biol. 52, 153, discussion 119 (1990).
- ↑ I. Prigogine, R. Lefever, Symmetries breaking instabilities in dissipative systems II. J. Phys. Chem. 48, 1695–1700 (1968)
- ↑ R. Lefever and G. Nicolis, Chemical instabilities and sustained oscillations, J. Theor. Biol. 30 (1971)
- ↑ G. Adomian, The diffusion-Brusselator equation. Comput. Math. Appl. 29, 1–3 (1995)
- ↑ 6,0 6,1 Scholz, Christian, Morphology of Experimental and Simulated Turing Patterns, 2009, p. 27-29.

























































![{\displaystyle A_{\pm }={\frac {1}{2}}\left[\beta \pm {\sqrt {\beta ^{2}-4(\Delta t)^{2}a^{2}b}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/28d0aaf05e256e36142debdbe659baa4d7ad5f48)