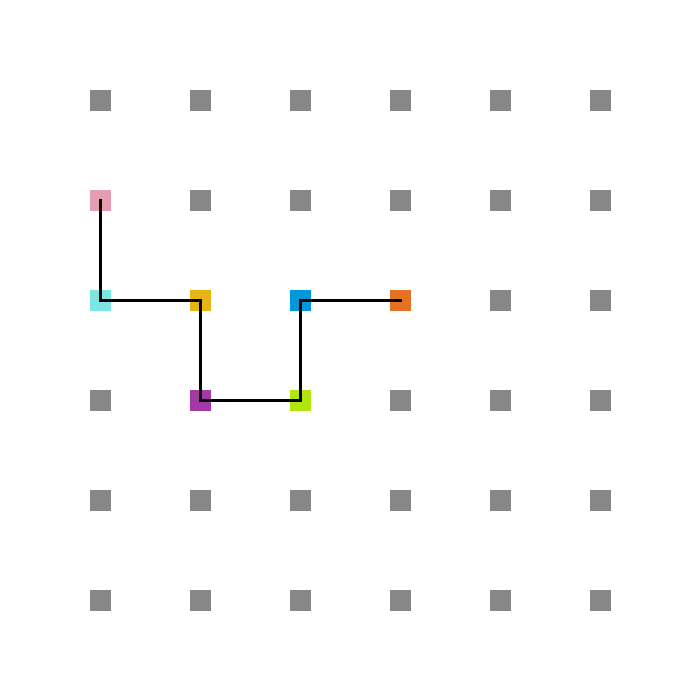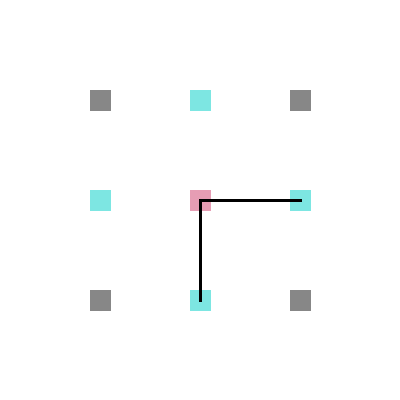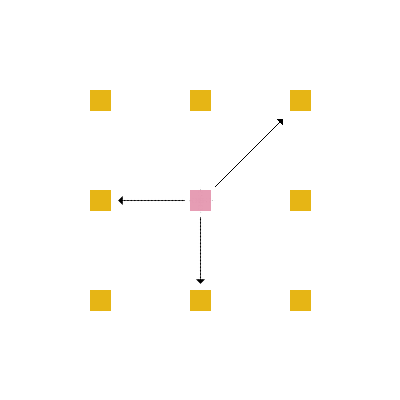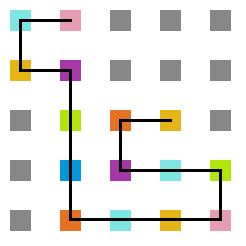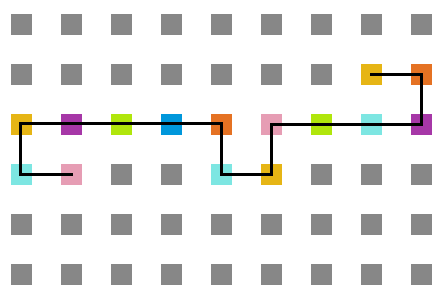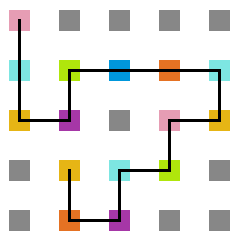Simulação de Enovelamento de Proteína: mudanças entre as edições
| Linha 69: | Linha 69: | ||
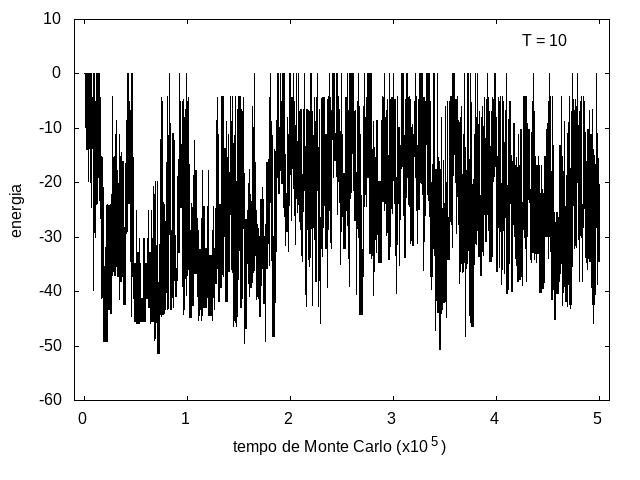
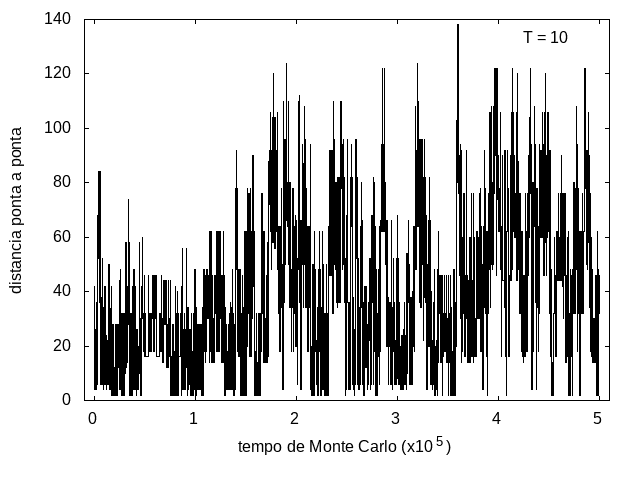
Nas figuras a seguir, temos a energia e o tamanho da cadeia (calculado como a distância ponta a ponta da cadeia) em função do tempo de simulação. Essa simulação foi feita com temperatura T = 10 e um total de 5x10<sup>5</sup> tempo de Monte Carlo. A temperatura alta permite que a proteína explore várias configurações e teste estruturas de diferentes energias, por isso, o gráfico tem tanta flutuação. Como várias estruturas diferentes são testadas, algumas são mais abertas e outras mais compactas, então o tamanho da cadeia também flutua bastante. | Nas figuras a seguir, temos a energia e o tamanho da cadeia (calculado como a distância ponta a ponta da cadeia) em função do tempo de simulação. Essa simulação foi feita com temperatura T = 10 e um total de 5x10<sup>5</sup> tempo de Monte Carlo. A temperatura alta permite que a proteína explore várias configurações e teste estruturas de diferentes energias, por isso, o gráfico tem tanta flutuação. Como várias estruturas diferentes são testadas, algumas são mais abertas e outras mais compactas, então o tamanho da cadeia também flutua bastante. | ||
<gallery widths= | <gallery widths=500px heights=500px> | ||
Arquivo:EnergiaT10.png|'''Figura 7''': Energia em função do tempo, T = 10 | Arquivo:EnergiaT10.png|'''Figura 7''': Energia em função do tempo, T = 10 | ||
Arquivo:TamanhoT10.png|'''Figura 8''': Tamanho da cadeia em função do tempo, T = 10 | Arquivo:TamanhoT10.png|'''Figura 8''': Tamanho da cadeia em função do tempo, T = 10 | ||
| Linha 76: | Linha 76: | ||
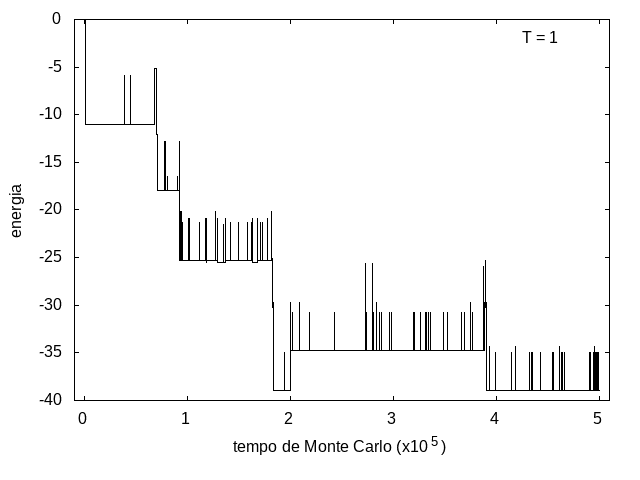
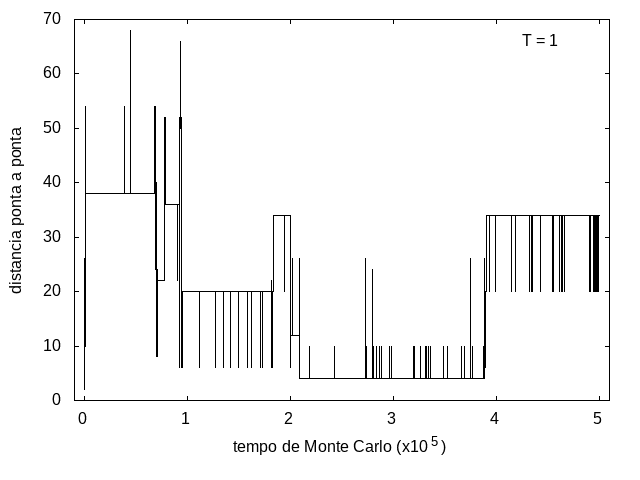
A simulação também foi feita para a temperatura T = 1, com o mesmo tempo de 5x10<sup>5</sup> tempo de Monte Carlo, e o resultado está nas figuras abaixo. As flutuações são menores e a proteína passa mais tempo em estruturas com energias mais baixas, porque a baixa temperatura não permite tanta movimentação. O tamanho também varia menos, e a proteína fica em estruturas mais compactas. | A simulação também foi feita para a temperatura T = 1, com o mesmo tempo de 5x10<sup>5</sup> tempo de Monte Carlo, e o resultado está nas figuras abaixo. As flutuações são menores e a proteína passa mais tempo em estruturas com energias mais baixas, porque a baixa temperatura não permite tanta movimentação. O tamanho também varia menos, e a proteína fica em estruturas mais compactas. | ||
<gallery widths= | <gallery widths=500px heights=500px> | ||
Arquivo:EnergiaT1.png|'''Figura 9''': Energia em função do tempo, T = 1 | Arquivo:EnergiaT1.png|'''Figura 9''': Energia em função do tempo, T = 1 | ||
Arquivo:TamanhoT1.png|'''Figura 10''': Tamanho da cadeia em função do tempo, T = 1 | Arquivo:TamanhoT1.png|'''Figura 10''': Tamanho da cadeia em função do tempo, T = 1 | ||
| Linha 84: | Linha 84: | ||
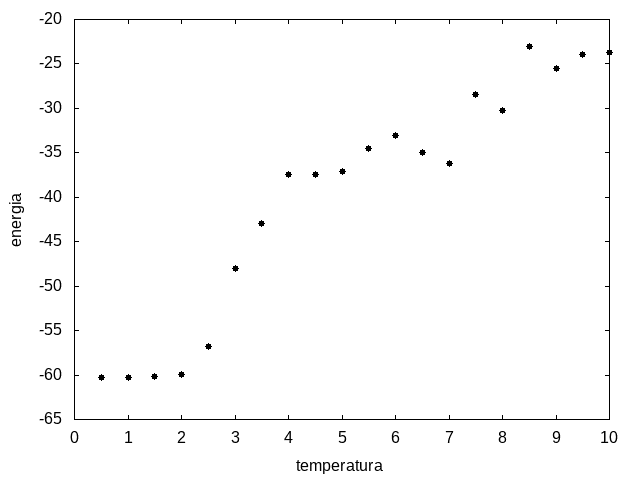
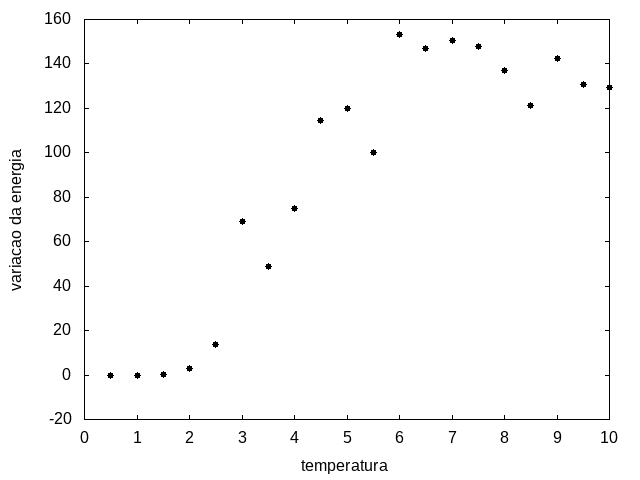
Outra simulação foi realizada partindo de uma temperatura alta e reduzindo-a gradativamente, para permitir que a proteína explore várias configurações nas temperaturas mais altas e consiga escolher uma de energia mais baixa. Em cada temperatura, a proteína passou 20x10<sup>5</sup> tempo de Monte Carlo. Os resultados, apresentados a seguir, são da média da energia e do tamanho em cada temperatura, e também a variância da energia em função da temperatura. | Outra simulação foi realizada partindo de uma temperatura alta e reduzindo-a gradativamente, para permitir que a proteína explore várias configurações nas temperaturas mais altas e consiga escolher uma de energia mais baixa. Em cada temperatura, a proteína passou 20x10<sup>5</sup> tempo de Monte Carlo. Os resultados, apresentados a seguir, são da média da energia e do tamanho em cada temperatura, e também a variância da energia em função da temperatura. | ||
<gallery widths= | <gallery widths=500px heights=500px> | ||
Arquivo:Energiaxtemp.png|'''Figura 11''': Média da energia em função da temperatura | Arquivo:Energiaxtemp.png|'''Figura 11''': Média da energia em função da temperatura | ||
Arquivo:Variacaoxtemp.png|'''Figura 12''': Variação da energia em função da temperatura | Arquivo:Variacaoxtemp.png|'''Figura 12''': Variação da energia em função da temperatura | ||
| Linha 94: | Linha 94: | ||
A seguir, algumas estruturas encontradas pela proteína durante as simulações. | A seguir, algumas estruturas encontradas pela proteína durante as simulações. | ||
<gallery widths= | <gallery widths=300px heights=300px caption="Simulação com T = 10" align="center"> | ||
Arquivo:T10_1e5.png|'''Figura 14''': Estrutura no tempo 1x10<sup>5</sup> | Arquivo:T10_1e5.png|'''Figura 14''': Estrutura no tempo 1x10<sup>5</sup> | ||
Arquivo:T10_3e5.png|'''Figura 15''': Estrutura no tempo 3x10<sup>5</sup> | Arquivo:T10_3e5.png|'''Figura 15''': Estrutura no tempo 3x10<sup>5</sup> | ||
Arquivo:T10_5e5.png|'''Figura 16''': Estrutura no tempo 5x10<sup>5</sup> | Arquivo:T10_5e5.png|'''Figura 16''': Estrutura no tempo 5x10<sup>5</sup> | ||
</gallery> | </gallery> | ||
Edição das 12h40min de 16 de maio de 2022
Carolina Lenzi
Este trabalho tem como objetivo utilizar o método de Monte Carlo para simular o enovelamento de proteínas.
Proteínas
As proteínas são moléculas com papel fundamental para os seres vivos. Elas atuam em diversos processos biológicos, como o transporte de oxigênio, a catálise de reações químicas, a defesa do organismo, a formação dos hormônios e formação de ossos e tendões. As proteínas são formadas por centenas de aminoácidos ligados em cadeia por ligações covalentes. Existem 20 aminoácidos proteinogênicos que dão origem às proteínas conhecidas e encontradas na natureza. Cada sequência de aminoácidos ligados covalentemente gera uma proteína diferente, com uma função específica no organismo. Essa sequência, bem determinada, é chamada de estrutura primária da proteína.
A proteína tende a se enovelar para minimizar a energia da sua estrutura, relativa às interações não covalentes (como ligações de hidrogênio, ponte salina, interações hidrofóbicas, interações iônicas…) entre os aminoácidos e com o meio. Isso é possível porque as ligações químicas possuem uma certa flexibilidade, que permite a rotação das moléculas. O enovelamento da estrutura primária gera regiões com padrões regulares na proteína, chamadas de estrutura secundária. Essas regiões regulares também tendem a se enovelar, dando origem a estrutura terciária da proteína. A estrutura terciária de menor energia é, geralmente, a conformação funcional da proteína, ou seja, sua configuração em estado biologicamente ativo, que é conhecida como forma nativa. Em alguns casos as estruturas terciárias podem se aglomerar e formar as estruturas quaternárias.
Como a função da proteína está diretamente relacionada com a sua forma nativa, e esta está relacionada com a sequência de aminoácidos que dá origem à proteína, é interessante conseguir prever a estrutura terciária a partir da estrutura primária, com a finalidade de desenvolver proteínas com características específicas. Esse é um dos grandes problemas da bioinformática atualmente. Além da complexidade de compreender a termodinâmica e o mecanismo do enovelamento, a proteína encontra a estrutura ótima em fração de segundo, mas o tempo que seria necessário para testar aleatoriamente as estruturas possíveis para encontrar a de menor energia é maior que a idade do universo, como apontado no paradoxo de Levinthal.
Simulação de Monte Carlo
A simulação do enovelamento foi feita com base no livro do Giordano e envolve um modelo muito simplificado do que acontece na realidade. O código foi implementado em C e os gráficos foram gerados no gnuplot.
Consideramos uma cadeia de N aminoácidos, sorteados dentre os 20 possíveis, para montar a estrutura primária da proteína, representada por um vetor de tamanho N. Aminoácidos em posições adjacentes do vetor são considerados ligados covalentemente. A cadeia é colocada em uma rede quadrada de tamanho NxN, para permitir que a proteína esteja completamente desenovelada (esticada).
Em cada posição da rede, um aminoácido tem no máximo 4 aminoácidos vizinhos mais próximos com os quais pode interagir ou estar ligado (figura 4) e no máximo 8 posições vizinhas para as quais ele pode se mover (figura 5).
Para as interações de não covalentes entre os aminoácidos, consideramos as seguintes forças atuantes:
- Forças de van der Waals: força atrativa para aminoácidos próximos, que perde o efeito com o aumento da distancia entre os aminoacidos;
- Ligações de hidrogênio: ligações entre aminoácidos próximos na rede;
- Interação com a água (hidrofilicidade e hidrofobia): aminoácidos hidrofílicos são atraídos pela água presente no meio e, por isso, tendem a manter a cadeia não enovelada. Já os hidrofóbicos repelem a água do meio e preferem uma estrutura enovelada.
Todas essas forças estão competindo no processo de enovelamento da proteína. Para o modelo, agrupamos essas interações em uma energia Jij, associada a um par de aminoácidos vizinhos na rede, A(m) e A(n) nas posições i e j, e não ligados covalentemente, ou seja, não adjacentes na cadeia. A energia da estrutura é dada pela soma sobre todos os pares de aminoácidos da proteína:
onde se os aminoácidos m e n são vizinhos na rede e não estão ligados covalentemente, e zero caso contrário.
A energia J pode ser pensada como uma matriz 20x20 contendo as interações relativas a todos os pares de aminoácidos, porém a matriz é simétrica, portanto, podemos guardar apenas 210 valores correspondentes aos pares distintos de aminoácidos.
Com essas definições, podemos partir para a simulação de Monte Carlo, esquematizada a seguir:
- Inicializar a cadeia e posicionar na rede
- Sortear um aminoácido da cadeia e encontrar sua posição na rede
- Calcular a energia inicial (Ei) da estrutura
- Sortear um dos 8 vizinhos da posição do aminoácido
- Verificar se é possível mover o aminoácido para a posição vizinha sorteada
- Se possível, mover o aminoácido e calcular a energia da nova estrutura (Ef)
- Se Ef < Ei, aceitar o movimento
- Se Ef >= Ei, aceitar o movimento com probabilidade do fator de Boltzmann
- Desfazer o movimento se ele não for aceito
- Contar um tempo de Monte Carlo a cada sorteio de vizinho
- Repetir a partir do passo 2.
A simulação consiste em repetir esses passos (a partir do 2) por longos tempos de Monte Carlo.
Resultados
Em todas as simulações, foi utilizada a mesma cadeia de 15 aminoácidos e os mesmos valores de energia Jij, que foram sorteados dentro do intervalo [-4, -2]. As energias foram medidas em unidades de kB por simplicidade. Incicialmente, a cadeia foi colocada esticada no meio da rede, como mostra a figura 6.
Nas figuras a seguir, temos a energia e o tamanho da cadeia (calculado como a distância ponta a ponta da cadeia) em função do tempo de simulação. Essa simulação foi feita com temperatura T = 10 e um total de 5x105 tempo de Monte Carlo. A temperatura alta permite que a proteína explore várias configurações e teste estruturas de diferentes energias, por isso, o gráfico tem tanta flutuação. Como várias estruturas diferentes são testadas, algumas são mais abertas e outras mais compactas, então o tamanho da cadeia também flutua bastante.
A simulação também foi feita para a temperatura T = 1, com o mesmo tempo de 5x105 tempo de Monte Carlo, e o resultado está nas figuras abaixo. As flutuações são menores e a proteína passa mais tempo em estruturas com energias mais baixas, porque a baixa temperatura não permite tanta movimentação. O tamanho também varia menos, e a proteína fica em estruturas mais compactas.
Outra simulação foi realizada partindo de uma temperatura alta e reduzindo-a gradativamente, para permitir que a proteína explore várias configurações nas temperaturas mais altas e consiga escolher uma de energia mais baixa. Em cada temperatura, a proteína passou 20x105 tempo de Monte Carlo. Os resultados, apresentados a seguir, são da média da energia e do tamanho em cada temperatura, e também a variância da energia em função da temperatura.
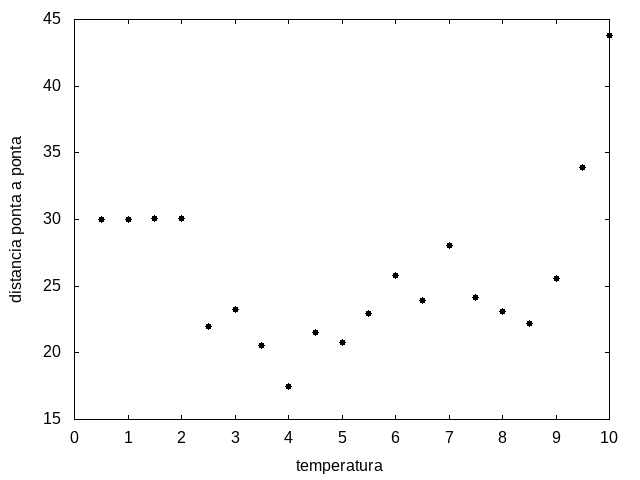
Percebemos, pelas figuras 11 e 12, que a energia da estrutura da proteína diminui com a temperatura, até T = 2, aproximadamente, onde não há mais uma mudança perceptível na energia. Isso indica que a proteína encontrou uma estrutura estável com energia baixa. A figura 13 também mostra estabilidade para temperaturas abaixo de 2, indicando que o estado enovelado da proteína não sofre alteração. Nesse caso, a estrutura encontrada pela proteína não é a mais compacta, mas é a de menor energia, dentre as testadas.
A seguir, algumas estruturas encontradas pela proteína durante as simulações.
- Simulação com T = 10